
改善熒光團的分離,并增加您可以在樣本中區分的熒光探針數量
在顯微鏡實驗中,通常需要同時分析樣本中的多種結構和分子。這可以通過使用不同顏色的熒光標記標記每個感興趣的特征來實現。然而,能夠成功區分的熒光團數量是有限的。多色共聚焦顯微鏡經常受到樣本中熒光探針光譜重疊的限制。本文探討了熒光團光譜分離中的常見挑戰以及如何克服這些挑戰,包括使用熒光壽命成像作為分離具有重疊光譜的熒光團的替代方法。
在本文中,我們探討了幾種策略,您可以采取這些策略來改善熒光團的分離,并增加您可以在樣本中區分的熒光探針數量。
多色共聚焦顯微鏡是當今細胞生物學實驗室中的一種基本技術。為了揭示生物系統的復雜性,需要能夠同時分析樣本中的多個結構、分子和微環境,并將它們相互關聯。這可以通過使用不同顏色的熒光標記或生物傳感器標記每個感興趣的特征來實現,然后進行同時或順序的多通道成像,以捕獲每個探針在特定通道中的信號。然而,這種“
考慮一個四色實驗,其中染料為 Alexa 488、Alexa 546、Alexa 568 和 TOTO-3(圖 1)。激發線必須仔細定位,以避免在每個通道中激發超過預期的染料。這可能會帶來一些權衡,例如由于偏離峰值中心而導致某些物種的激發效率低下。更重要的是,發射曲線的強光譜重疊使得避免串擾偽影成為一項挑戰。因此,很難判斷在受影響的圖像通道中,實際上是哪個熒光染料產生了你所看到的信號。
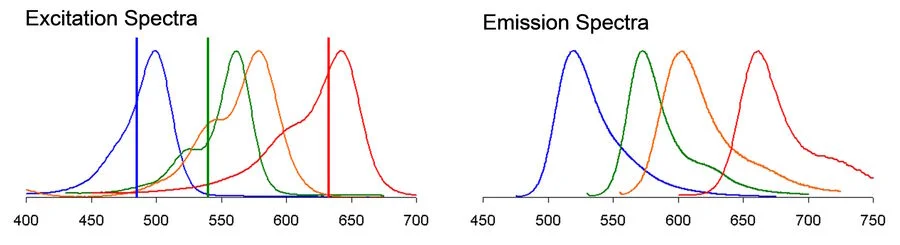
圖 1:Alexa 488、Alexa 546、Alexa 568 和 TOTO-3 的激發和發射光譜。
為了說明串色如何影響實驗結果,圖 2(A)顯示了僅兩個熒光染料的典型激發曲線,一個綠色和一個紅色。如圖 B 所示,這兩種染料的相應發射曲線重疊。如果樣品中兩種染料的發射水平不可比,重疊的相對比例可能會更顯著(C)。當發射的光通過檢測器(在這個假設的情況下通過帶通濾光片)時,兩個熒光染料的信號都在紅色通道中被檢測到(D)。
像這樣的串色偽影可能導致數據解釋中的嚴重錯誤,特別是在研究亞細胞熒光染料的共定位或需要定量測量時。例如,當將前面示例中的綠色和紅色通道圖像疊加時,會看起來好像這兩種染料部分共定位,而實際上它們被分隔在不同的亞細胞區室中(圖 3)。串色還可能影響依賴于強度測量的實驗,例如涉及福斯特共振能量轉移(FRET)或光漂白后的熒光恢復(FRAP)。
圖 2:2a:綠色通道的發射光譜 - 所有FITC發射的?進入綠色通道,而?進入紅色通道。2b:紅色通道的發射光譜 - 所有 TRITC 發射的 1/5 進入綠色通道,而 4/5 進入紅色通道。2c:雙標記樣品的發射信號。黑色曲線表示兩個熒光團信號的總和。
在為多色共聚焦實驗準備樣本時,有許多重要的考慮事項和措施可以采取,以避免或減少由光譜重疊引起的偽影。
01熒光染料選擇
考慮是否可以用具有更窄發射峰和/或更大斯托克斯位移(激發和發射最大值之間的分離)的染料替代潛在問題熒光染料。例如,熒光量子點(QD)具有多種適合多重標記的特性,包括相對較窄和對稱的發射曲線、光譜中均勻分布的多種顏色選擇,以及能夠使用相同激發波長同時激發多個光譜變體的能力。一些基因編碼的熒光蛋白(FP)也經過工程改造以改善多重標記,例如Keima和LSSmOrange,它們具有異常大的斯托克斯位移,使得與傳統熒光蛋白和化學染料結合時能夠進行單次激發的多色成像。
02 發射強度的平衡
如果樣本中熒光團的發射強度水平存在顯著差異,強熒光物種的信號可能會淹沒弱熒光物種的信號,從而導致特定通道中不成比例的串擾(見圖2)。目標豐度、染料濃度、量子產率、光穩定性和照明強度都是可能導致發射不平衡的因素。如果樣本中不同目標的豐度差異很大,明智的做法是將最亮和最光穩定的染料保留給豐度的目標。在樣本準備過程中,熒光探針的濃度應仔細滴定。在某些情況下,這可能不可行,例如在成像表達差異調控FP物種的活細胞時。在這種情況下,可以通過使用陽性和陰性對照樣本優化每個通道的激發強度,在圖像采集階段補償不平衡。
03 對照樣本的準備
單染色對照樣本對于評估和減少在優化圖像采集參數時的串擾至關重要。它們還提供了可以用于后續光譜解混的信息,并支持實驗結論(例如,在發布共定位研究或定量顯微鏡方法的結果時)。對于活細胞檢測,準備有刺激和無刺激的重復單染色樣本(即陽性和陰性對照)非常重要,以便評估在預期的動態范圍內潛在的串擾和其他偽影,并相應地調整采集設置。
圖 3:HeLa 細胞(成纖維細胞);藍色:Dapi,細胞核;綠色:Alexa 488,微管;紅色:TRITC 鬼筆環肽,肌動蛋白;灰色:Mito Tracker Red CMXRos,線粒體。
一旦樣品準備得到優化,下一步至關重要的步驟是優化采集參數。
01 儀器配置和采集設置
光學光路的最佳設置,包括激光器的選擇、激發波長、濾光組合和檢測帶寬,對于最小化光譜串擾至關重要,尤其是在同時掃描期間。可能需要對儀器設置和樣品準備采取迭代方法,以找到最小化偽影和實現可靠檢測和定量所需的動態范圍之間的理想平衡。這在活細胞實驗中尤其具有挑戰性,因為熒光蛋白表達水平和染料濃度可能會廣泛且不可預測地變化。
02 順序成像
在進行同時多通道成像時,可能會出現由于激發或發射光譜交叉而產生的偽影。在兩種熒光染料的激發光譜足夠分離但發射特征重疊的情況下,可以通過一次使用一個激發線的順序成像來避免串擾。由于激發和發射特征在其不對稱性上往往相互鏡像,激發光譜的交叉傾向于發生在光譜的藍端(短波長),此時峰值往往有較長的尾部,而發射光譜更可能在光譜的紅端(長波長)有延伸的重疊尾部。這意味著短波長的熒光探針更可能滲透到長波長通道中,而不是反過來。因此,獲取圖像的順序可能會有所不同。通常建議先用最長波長激發,然后依次向短波長工作。順序掃描的一個缺點是,對于某些應用(例如監測活細胞中的快速動態事件),它可能太慢。此外,順序成像無法防止在兩個或多個熒光探針被同一激光線激發的情況下出現串擾。
盡管付出了最大的努力,但在實驗的前分析步驟中,可能無法防止或充分減少排放不平衡和光譜重疊。幸運的是,在圖像采集后,仍然可以通過分析方法光譜分辨樣品中的熒光團。為了將每個熒光團的信號數學上恢復到其各自的通道,解混算法通常基于線性解混或聚類分析方法。前者依賴于用戶估計的分布或使用參考光譜來計算每個成分熒光團的分布系數。聚類分析方法提供了一個良好的替代方案。在沒有光譜信息的情況下,線性解混的替代方案。與使用參考光譜不同,主要的分布系數是通過擬合確定的。
盡管光譜解混工具非常有用,但它們在樣本中解析熒光探針的能力有兩個主要限制。第一個限制是光譜解混受到系統中探測器數量的限制。換句話說,您無法解混超過系統能夠檢測的顏色。第二個主要限制是光譜解混算法無法區分相同顏色的熒光團,即那些具有相似發射光譜的熒光團。
但是,如果有一種方法可以克服光譜成像的局限性,而無需向系統添加其他探測器或尋找替代的熒光染料呢?關鍵在于超越光譜信息的分析,增加另一個維度的分析:熒光壽命。熒光壽命是指熒光染料在發射光子之前處于激發態的時間。壽命信息與熒光強度信息是正交的,可以用來區分具有相似光譜但壽命不同的染料(圖4)。最近在壽命分析技術方面的進展使得將壽命檢測能力集成到共聚焦掃描頭中成為可能,從而可以同時收集壽命和光譜信息。結果是能夠結合壽命和光譜信息,利用基于壽命的信息區分更多的熒光染料。
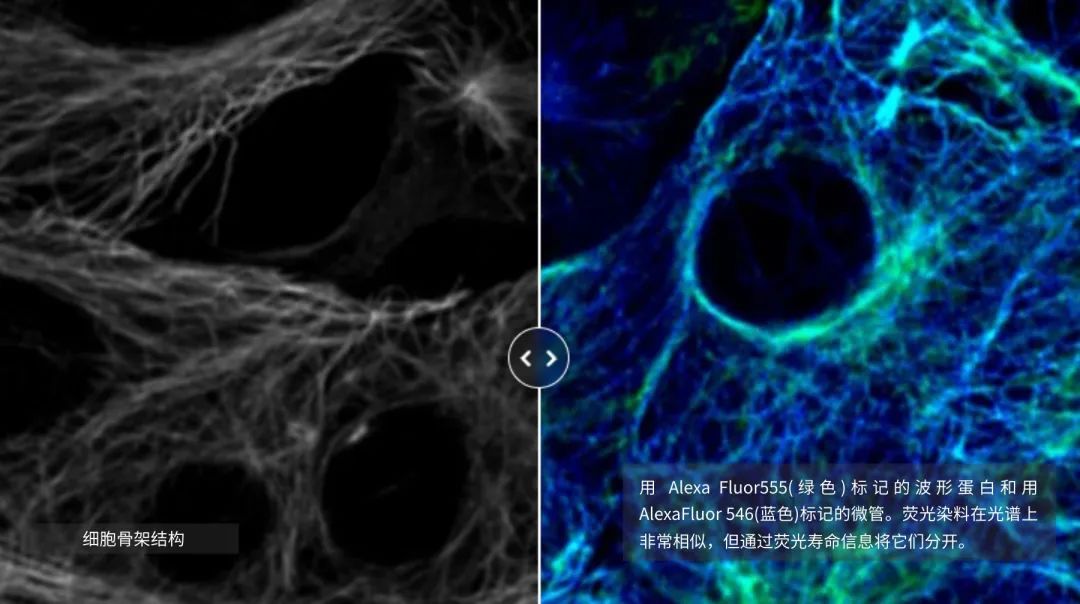
圖 4:通過壽命對比區分的細胞骨架結構。
在多色共聚焦顯微鏡中,熒光探針的良好光譜分離對于獲得高質量結果和在實驗中包含更多熒光探針至關重要。在成像之前,仔細優化樣品和儀器設置在減少不必要的光譜重疊引起的偽影方面起著重要作用。曾幾何時,圖像采集后幾乎沒有什么可以做的來改善結果,但通過光譜解混方法,現在可以在采集后解決重疊問題,盡管成像條件不理想。值得注意的是,在共聚焦平臺上實施壽命成像的開創性進展,現在使得強大的熒光壽命能力能夠無縫集成到共聚焦顯微鏡工作流程中,為科學家提供了區分以前無法通過光譜解混區分的熒光探針的能力。
相關產品

STELLARIS共聚焦顯微鏡平臺
點擊此處申請樣機試用
電話
微信掃一掃
